مقدمة في التركيبات الكيميائية
تستخدم الصيغ الكيميائية لوصف تركيبة الجزيء وتحديد خصائصه. يتم تمثيل العناصر التي يتكون منها المركب برموزها الكيميائية،
ويتم تمثيل عدد ذرات كل عنصر بواسطة حرف منخفض. على سبيل المثال، يحتوي الماء على ذرتين من الهيدروجين وذرة أكسجين واحدة (H2O). توفر الصيغ الكيميائية أيضًا معلومات حول الترتيب الهيكلي للذرات في الجزيء. على سبيل المثال، يحتوي ثاني أكسيد الكربون على ذرتين من الأكسجين مرتبطة بذرة كربون واحدة (CO2). توضح الصيغ الهيكلية بالضبط كيف ترتبط كل ذرة بذرة أخرى، مما يسمح لنا بتحديد أنواع مختلفة من الجزيئات. يمكن أن تكون الصيغ الجزيئية مفيدة في التعرف على المركبات بسرعة، لكنها لا تخبرنا بأي شيء عن كيفية ترتيب الذرات في الفضاء.
المكونات الأساسية للصيغة الكيميائية
تستخدم الصيغ الكيميائية لتمثيل تركيبة المركب الكيميائي. أنها توفر معلومات حول العناصر التي يتكون منها المركب ونسبها النسبية. يمكن أن تتضمن الصيغ الكيميائية رموزًا تمثل الذرات، وأرقامًا منخفضة تشير إلى عدد الذرات، ونصوص مرتفعة تشير إلى الشحنة. بالإضافة إلى ذلك، يمكن استخدام المعاملات للإشارة إلى عدد جزيئات مركب معين. توفر الصيغ الجزيئية معلومات أكثر تفصيلاً حول التركيب الجزيئي من خلال إظهار كيفية ارتباط الذرات المختلفة ببعضها البعض في الجزيء. تُظهر الصيغ التجريبية النسب النسبية للعناصر في مركب ولكن ليس ترتيبها أو روابطها. إن معرفة مكونات الصيغة الكيميائية أمر ضروري لفهم طبيعة وسلوك المركبات المختلفة في الكيمياء.

كتابة الصيغ للمركبات الأيونية
على سبيل المثال، صيغة بيكربونات الزنك هي Zn (HCO3) 2، الكوبالت (III) فوسفات هو Co3 (PO4) 2، سيلينيد الغاليوم هو GaSe ويوديد السترونتيوم هو SrI2. لإيجاد الصيغة الكيميائية للمركب الأيوني، يجب أن تفكر في شحنات الكاتيونات والأنيونات التي يتكون منها المركب. تحتاج بعد ذلك إلى استخدام هذه الشحنات لموازنة المعادلة بحيث تكون متعادلة كهربائيًا. لكتابة صيغة كيميائية لمركب أيوني، ابدأ بكتابة رموز وشحنات كل أيون موجود في المركب. بمجرد تحديدها، ادمجها بطريقة لا توجد بها شحنات موجبة أو سلبية بشكل عام. على سبيل المثال، إذا كان كلوريد الصوديوم يحتوي على كاتيون صوديوم واحد وأنيون كلوريد واحد، فإن صيغته الكيميائية ستكون NaCl لأن كلا الأيونات معًا تخلق شحنة متعادلة.
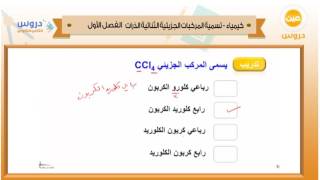
تسمية المركبات الجزيئية الثنائية
تسمية المركبات الجزيئية الثنائية هي عملية بسيطة تتطلب فهم الصيغ الكيميائية والعناصر المعنية. يُعطى العنصر الأول في المركب اسمه الكامل للعنصر، بينما يُعطى العنصر الثاني جذره (hydr، bor، carb، ox، fluor، إلخ) متبوعًا بـ "id". على سبيل المثال HCl هو كلوريد الهيدروجين و H2Se هو سيلينيد الهيدروجين. بالإضافة إلى هذه القاعدة الأساسية، هناك قواعد أخرى يجب مراعاتها عند تسمية المركبات الجزيئية الثنائية مثل تلك التي تتضمن معادن وغير فلزية. عند كتابة صيغة لمركب جزيئي، من المهم التعرف على العنصر الأقل كهرسلبية في الزوج باعتباره العنصر الأول في الصيغة. تتحد المعادن مع اللافلزات لإعطاء مركبات أيونية ؛ عند تسمية المركبات الأيونية الثنائية، من المهم تسمية الكاتيون أولاً (تحديد الشحنة إذا لزم الأمر) ثم متبوعًا باسم الأنيون. تتكون الأحماض الثنائية من الهيدروجين وأنيون اللافلزية ؛ بالنسبة لهذه الأنواع من المركبات، يجب إضافة بادئة مائية قبل اسم الأنيون اللافلزي. أخيرًا، عند التعامل مع الأيونات متعددة الذرات، من المهم التعرف على أسمائها قبل استخدامها في الصيغ أو أسماء الجزيئات التي تحتوي عليها.

كتابة الصيغ للأيونات متعددة الذرات
لكتابة الصيغة الكيميائية لمركب أيوني يحتوي على أيونات متعددة الذرات، ابدأ بإيجاد اسم وشحنة كل أيون متعدد الذرات من جدول الأيونات المشترك. اكتب الأيونات: الكاتيون على اليسار، الأنيون على اليمين. اعبر الرقم الموجود في الشحنة. على سبيل المثال، إذا كان لديك كاتيون بشحنة +2 وأنيون بشحنة -1، فستكتب 2+ و 1 على التوالي. يجب أن تبدو الصيغة النهائية كما يلي: [الكاتيون] 2+ [أنيون] 1-. لاحظ أنه في المركبات المكونة من أيونات متعددة الذرات، يُشار إلى عدد الأيونات الموجودة في المركب من خلال إرفاق صيغة الأيونات بين قوسين.
استخدام الأقواس في الصيغ الكيميائية
يعد استخدام الأقواس في الصيغ الكيميائية طريقة شائعة لتجميع الذرات معًا والإشارة إلى نسبة كل عنصر في المركب. يسمح هذا للكيميائيين بتحديد التركيب الجزيئي للمركب بسرعة. تستخدم الأقواس بشكل شائع عند التعامل مع الأيونات متعددة الذرات، وهي أيونات تحتوي على أكثر من ذرة واحدة. في هذه الحالة، يتم وضع الأقواس حول رمز الأيون ويضاف بعده رقم منخفض للإشارة إلى عدد هذه الأيونات الموجودة في الجزيء. على سبيل المثال، سيتم تمثيل كلوريد الصوديوم على شكل NaCl، بينما سيتم تمثيل نترات المغنيسيوم على شكل Mg (NO3) 2. تؤثر الحروف السفلية خارج الأقواس على جميع العناصر الموجودة داخل الأقواس بالتساوي، على سبيل المثال، سيكون H2O2 ذرتين من الهيدروجين واثنين من ذرات الأكسجين في المجموع.

العمل مع الأحماض والقواعد
تستخدم الصيغ الكيميائية لتمثيل تركيبة المركبات الكيميائية والتفاعلات. وهي تتكون من رموز لكل عنصر موجود في المركب أو التفاعل، بالإضافة إلى الرموز الفرعية والرموز الأخرى التي تشير إلى عدد الذرات وترتيبها. يتضمن العمل مع الأحماض والقواعد فهم كيفية تفاعل هذه المركبات عند دمجها. الأحماض هي مواد تطلق أيونات الهيدروجين (H +) عندما تذوب في الماء، بينما القواعد هي مواد تطلق أيونات الهيدروكسيد (OH-) عندما تذوب في الماء. عند مزجها، يمكن للأحماض والقواعد تحييد بعضها البعض عن طريق تكوين ملح، وهو نوع من المركبات الأيونية التي تحتوي على كاتيونات معدنية مدمجة مع أنيون مشتق من الحمض أو القاعدة.
يمكن تصنيف المركبات الأيونية التي تحتوي على هيدروكسيد (OH-) على أنها قواعد لأن إزالة أيونات H + من جزيئات الماء يزيد من تركيز OH- أيون في المحلول. الماء نفسه هو مثال ممتاز على هذا السلوك لأنه يعمل كحامض وقاعدة في نفس الوقت نظرًا لقدرته على تكوين أيونات H3O + و OH. العديد من الأحماض الشائعة لها صيغ كيميائية تبدأ بـ "H" مثل حمض النيتريك (HNO3)، وحمض الكربونيك في المشروبات الغازية (H2CO3)، وحمض البوريك (H3)

تفاعلات ومنتجات التحييد
الصيغة الكيميائية لتفاعل التعادل هي حمض مضافًا إليه مادة أساسية ينتج عنها ماء وملح. يتبرع الحمض بأيونات الهيدروجين موجبة الشحنة (H +)، بينما تتبرع القاعدة بأيونات الهيدروكسيد سالبة الشحنة (OH-). عندما يتحد هذان الأيونات، فإنهما يشكلان ماءً ليس له شحنة، والملح الذي يتكون من الكاتيون من القاعدة والأنيون من الحمض. على سبيل المثال، يتفاعل حمض الهيدروكلوريك (HCl) مع هيدروكسيد الصوديوم (NaOH) لتكوين الماء وكلوريد الصوديوم ملح الطعام (NaCl): HCl + NaOH → NaCl + H2O. يمكن أيضًا كتابة التفاعل من حيث مكوناته: H + + OH- → H2O + Na + + Cl-.

كتابة المعادلات الجزيئية
لكتابة معادلة جزيئية، فإن الخطوة الأولى هي تحديد المواد المتفاعلة والنواتج. يمكن القيام بذلك من خلال النظر إلى الصيغة الكيميائية لكل مركب. بعد تحديد هذه المكونات، يجب كتابتها كمعادلات جزيئية. هذا يعني أنه يجب ذكر الرموز الكيميائية لكل عنصر مع الرموز الفرعية الخاصة بكل منها والتي تشير إلى عدد ذرات كل عنصر موجودة في الجزيء. بمجرد كتابة جميع المواد المتفاعلة والنواتج، قد يلزم إضافة المعاملات من أجل موازنة المعادلة بحيث تكون هناك كميات متساوية من الذرات على جانبي المعادلة. مثال على المعادلة الجزيئية المتوازنة هو: 2H2 + O2 -> 2H2O، والتي تظهر جزيئين من الهيدروجين يتفاعلان مع جزيء واحد من الأكسجين لإنتاج جزيئين من الماء.

حساب الكتل المولية من الصيغ الكيميائية
تعتبر الكتلة المولية مفهومًا مهمًا في الكيمياء وتستخدم لحساب كتلة مركب كيميائي بناءً على صيغته الكيميائية. يتم تحديده عن طريق جمع الكتل الذرية لجميع الذرات في الجزيء. على سبيل المثال، يحتوي مول واحد من الماء (H2O) على كتلة مولارية تبلغ 18.015 جم / مول لأنه يحتوي على ذرتين هيدروجين بكتلة ذرية تبلغ 1.008 جم / مول وذرة أكسجين بكتلة ذرية تبلغ 16.00 جم / مول. لحساب الكتلة المولية من صيغة كيميائية، ببساطة اجمع العدد الإجمالي لكل حاضر مضروبًا في كتلتها المولية لكل عنصر في المركب. على سبيل المثال، إذا أردت معرفة الكتلة المولية لكلوريد الصوديوم (NaCl)، فستحدد أولاً أنها تحتوي على ذرة صوديوم بكتلة مولارية 22.99 جم / مول وذرة كلور بكتلة مولارية 35.45 جم / مول، لذلك ستضرب هذه الأرقام على التوالي (22.99 × 1 = 22.99 و 35.45 × 1 = 35.45) ثم تجمعها معًا للحصول على 58.44 جم / مول كالكتلة المولية الكلية لكلوريد الصوديوم

استخدام الجدول الدوري لتسمية العناصر في صيغة
في هذه الحالة، الصيغة الكيميائية واسم المركب المكون من العنصر K هو كلوريد البوتاسيوم، والذي يُكتب على أنه KCl. يشير الرمز السفلي إلى وجود ذرة واحدة من البوتاسيوم وذرة واحدة من الكلوريد في الجزيء.

تحديد الجزيئات التي تحتوي على معادن انتقالية
عند تحديد الجزيئات التي تحتوي على معادن انتقالية، من المهم فهم أسماء وصيغ المركبات. تتم كتابة الصيغة الكيميائية للمركب الذي يحتوي على معدن انتقالي باستخدام رمز العنصر وشحنته (إن أمكن). على سبيل المثال، ستتم كتابة كلوريد النحاس (II) كـ CuCl2. لا يتم استخدام البادئات في التسمية، ولكن في بعض الأحيان يتم استخدام الأرقام الرومانية (للمعادن الانتقالية ذات الرسوم المتغيرة). في كتابة الصيغ، يجب أن تكون الشحنات متوازنة دائمًا - بمعنى أن مجموع كل الشحنات الموجبة يجب أن يساوي مجموع كل الشحنات السالبة.
عند تسمية مركب أيوني بمعدن انتقالي، من المهم استخدام الأرقام الرومانية بعد اسم العنصر للإشارة إلى شحنته. على سبيل المثال، يمكن كتابة أكسيد الحديد (III) بالشكل Fe2O3. المجموعات من III B إلى II B (3-12) عبارة عن معادن انتقالية. تشكل هذه العناصر الكاتيونات عندما تتفاعل مع اللافلزات مثل الأكسجين أو الكلور. لكتابة الصيغ الخاصة بهم بشكل صحيح، من المهم النظر في حالات الأكسدة الخاصة بهم وتعديلها وفقًا لذلك للتأكد من أن كلا الأيونات لها شحنة متساوية ومعاكسة توازن بعضها البعض في الجزيء.
يتضمن تمكين ML في كيمياء المعادن الانتقالية ذات الغلاف المفتوح فهم كيفية معادن المجموعة الرئيسية

العمل مع الهيدرات والأيونات المركبة
يتكون الهيدرات من مركب أيوني وجزيئات الماء. يتم تجميع جزيئات الماء معًا بواسطة روابط هيدروجينية، والتي تعطي التركيب البلوري للهيدرات شكله المميز. يمكن تحديد الهيدرات من خلال صيغتها التجريبية، والتي تشير إلى نسبة الكاتيونات والأنيونات (الأيونات الموجبة والسالبة الشحنة على التوالي) إلى عدد جزيئات الماء في المركب. من أجل تحديد اسم الهيدرات، يجب على المرء تحديد المركب الأيوني الموجود فيه بالإضافة إلى محتواه المائي. على سبيل المثال، إذا كانت الهيدرات تحتوي على مول واحد من كلوريد الصوديوم وستة مولات من الماء، فيشار إليها على أنها كلوريد الصوديوم سداسي الماء (NaCl • 6H2O). علاوة على ذلك، عند العمل مع الهيدرات، من المهم أن تضع في اعتبارك أن الجفاف سيحدث إذا تم تطبيق الحرارة عليها أو إذا تم تخزينها في بيئة منخفضة الرطوبة.

فهم الايزومرات الهيكلية في الكيمياء العضوية
الأيزومرات الهيكلية هي مركبات لها نفس الصيغة الجزيئية، ولكن بترتيبات هيكلية مختلفة. إنها جزيئات تختلف في طريقة ارتباط ذراتها ببعضها البعض، مما يؤدي إلى خصائص مختلفة. تتضمن أمثلة الأيزومرات الهيكلية الألكانات والألكينات والألكينات. الألكانات لها ترتيب خطي من الذرات بينما الألكينات لها ترتيبات متفرعة من الذرات. يؤثر هذا الاختلاف على الخصائص الفيزيائية والكيميائية للجزيئات ؛ على سبيل المثال، تحتوي الألكينات على نقاط غليان أعلى من الألكانات لأنها يمكن أن تشكل قوى بين الجزيئات أقوى بسبب بنيتها المتفرعة.
من أجل تحديد الأيزومرات الهيكلية، من المهم فهم كيفية تأثير الروابط المزدوجة والثلاثية على ترتيب الذرات في الجزيء العضوي. تؤدي الروابط المزدوجة إلى ربط مجموعتين من الذرات المترابطة بذرة مركزية بينما تؤدي الروابط الثلاثية إلى ربط ثلاث مجموعات. هذا له تأثير على شكل الجزيء وكذلك تفاعله مع الجزيئات الأخرى عند تكوين مركبات أو مواد جديدة.
بالإضافة إلى ذلك، فإن فهم الأيزومرية الفراغية (دراسة الهياكل الجزيئية التي تختلف فقط بترتيبها المكاني) يساعد أيضًا في تحديد الأيزومرات الهيكلية حيث يمكن أن يحدث هذا النوع من الأيزومرية أيضًا بين

استنتاج
تستخدم الصيغ الكيميائية لوصف مكونات المركب الكيميائي أو التفاعل أو العملية بدقة. أنها توفر وسيلة فعالة لتوصيل المعلومات حول العناصر والجزيئات المشاركة فيها. تُستخدم الصيغ الكيميائية أيضًا لحساب كمية الطاقة المطلوبة لحدوث تفاعل، وكذلك للتنبؤ بالمنتجات التي سيتم تشكيلها. بالإضافة إلى ذلك، يمكنهم مساعدة الكيميائيين على فهم خصائص نظام معين والتحكم فيها. باستخدام الصيغ الكيميائية، يمكن للكيميائيين تحديد المواد وتطوير مواد جديدة بخصائص محددة يمكن أن تكون مفيدة للعديد من التطبيقات.
الخلاصة: الصيغ الكيميائية ضرورية لفهم التفاعلات والعمليات الكيميائية ومعالجتها. إنها تسمح لنا بتوصيل المعلومات بدقة حول العناصر والجزيئات ومتطلبات الطاقة والمنتجات التي تشكلت كجزء من تفاعل أو عملية. بهذه المعرفة يمكننا بعد ذلك تطوير مواد جديدة بخصائص محددة لها العديد من التطبيقات العملية.






.png)




0 تعليقات
أهلا بك في موقع عُمان التعليمية - نرحب بنشر تعليقاتك البناءة و مساهماتك الطيبة - دائما نستمع بإهتمام لطلباتكم وآرائكم .. بالتوفيق